转基因小鼠
制作转基因小鼠最常用的⼀种方法是DNA原核显微注射。DNA原核显微注射是指将外源DNA通过显微注射的方法注射到受精卵的原核内,注射DNA整合到小鼠受精卵的基因组中,并稳定遗传给后代。
PiggyBac(PB)系统打造高效转基因技术
PiggyBac(PB)系统是利用PB转座子特有的"剪切和粘贴"机制,使DNA片段在载体和基因组之间"自由"的转移,从而有效介导外源DNA片段对基因组的整合。转座时,转座酶有效的识别特异的转座子序列(ITRs),与转座子末端结合形成短暂的发夹结构,"剪切"后脱离,"粘贴"至基因组的TTAA位点。粒成生物实验数据表明,PiggyBac系统基因表达阳性率为常规质粒DNA显微注射的2倍以上!
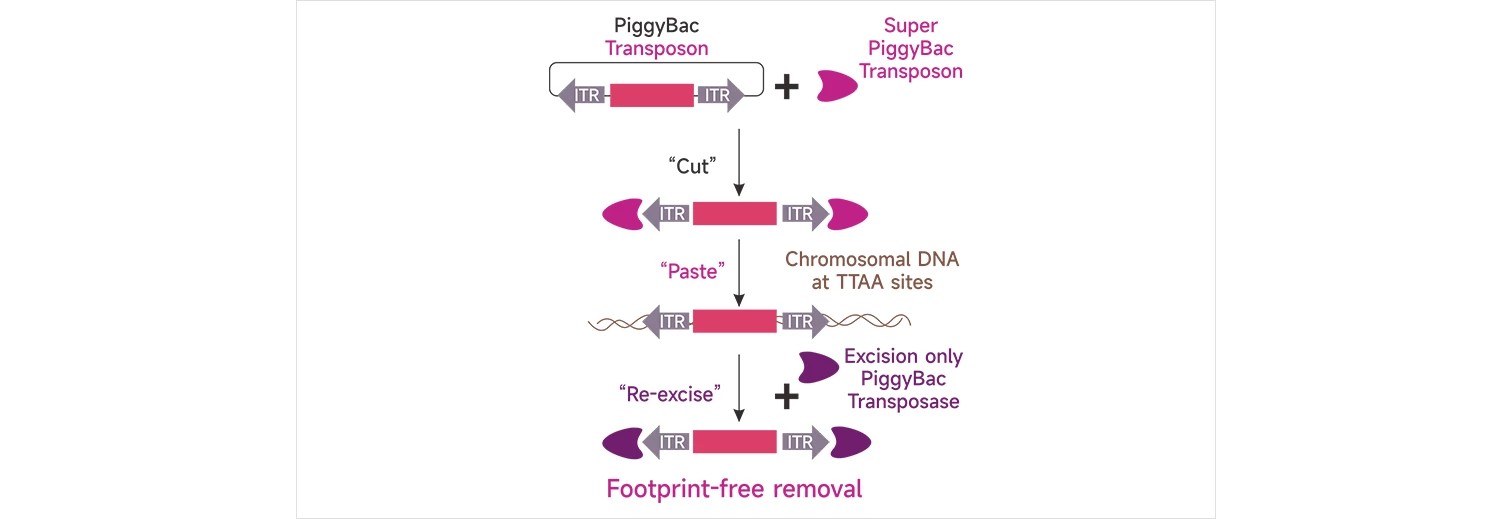
PiggyBac(PB)系统五大优势
- 更高的整合效率
- 更高的目的基因表达概率
- 更大的目的片段的插⼊
- 更"精确"拷贝数的插⼊
- 可自由移除插入片段
服务流程和周期

动物品系
C57BL/6小鼠
目前公布的小鼠基因组测序结果来源于C57BL/6小鼠品系。该品系小鼠模型已广泛应用于肿瘤、免疫、遗传学等方面的研究,并已成为发表文章的首选小鼠品系。
FVB小鼠
原核大、清晰、近交品系,基因型比较单一;具有易于原核注射的优点。
转基因小鼠类型
过表达转基因小鼠
通过构建广泛性、组织特异性、诱导性等不同启动子和目的基因的表达载体,利用原核显微注射的方法将线性化后的表达载体注射到小鼠受精卵中,实现转基因在广泛性、组织特异性等特定条件下的表达。

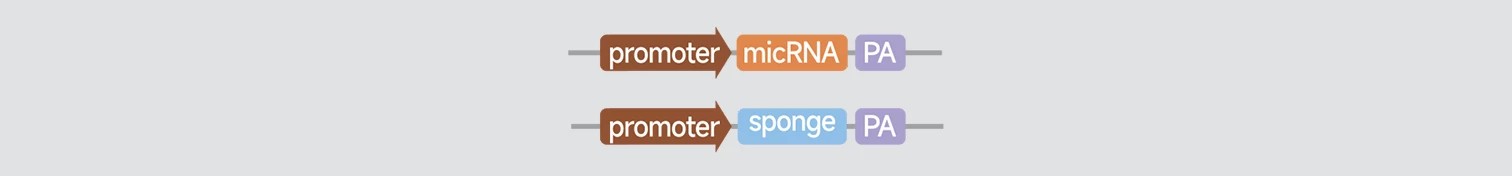
microRNA转基因小鼠
构建以下两种microRNA表达载体,通过原核显微注射将载体注射到受精卵中,实现microRNA过表达或者下调。
RNA转基因小鼠
通常采用U6/H1驱动shRNA表达,设计靶序列构建shRNA载体,利用原核显微注射的方法将shRNA载体注射到受精卵中,在基因表达的过程中,通过shRNA的干扰作用,达到对目的基因表达的沉默抑制,实现基因功能的研究。

可诱导性/组织特异性转基因小鼠
将构建的广泛表达启动子-loxp-stop-loxp-转基因载体通过显微注射制备组织特异性转基因大(小)鼠模型,转基因在正常情况下并不表达,只有与相应的组织特异性表达Cre/CreERT2小鼠杂交后,因Stop终止序列在特定的组织中被去除,从而达到转基因在诱导性/特定组织中特异性表达的目的。

BAC转基因小鼠
Bacterial artificial chromosomes(BACs)是处理大片段DNA的重要工具。由于其完整性和保真度,可以更好的解释转基因的重要功能。因此,为了研究完整的内含子特异性、基因结构及调控元件等,可以将BAC直接进行原核显微注射(约几十到几百Kb)或者将其改造后注射在小鼠或大鼠的受精卵中,以获得转基因鼠。
转基因小鼠建系原则与流程
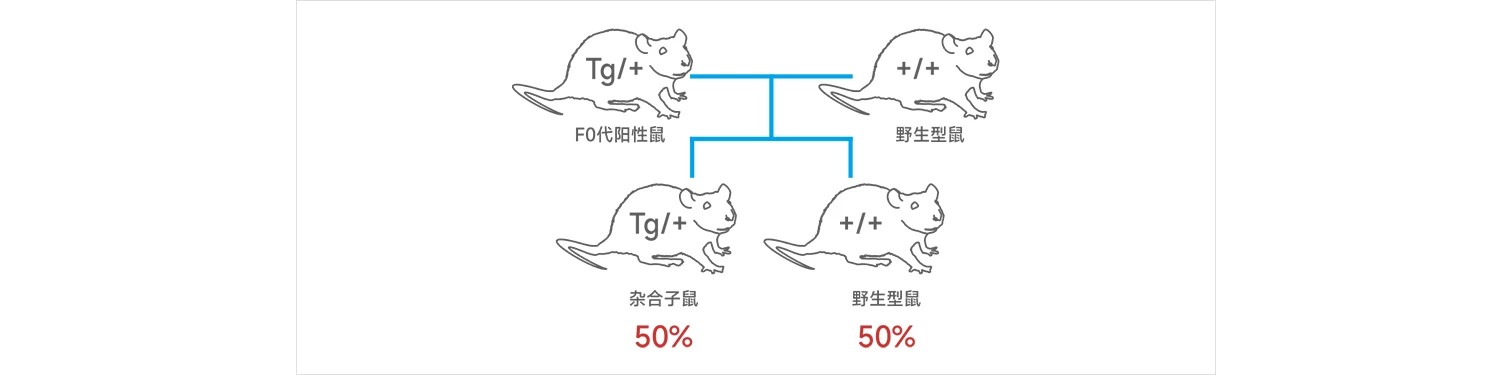
1. 原核显微注射获得PCR阳性F0代杂合子小鼠。原核显微注射导入的目的基因是将目的基因随机整合到小鼠的基因组,首代转基因小鼠(F0)将会有不同的整合位点,整合基因的拷贝数可能在不同的首代转基因小鼠中也不同。因此,每只F0代小鼠需要作为一个独立的谱系研究,并且与其它F0代小鼠分开进行繁殖。
2. F0代小鼠达到性成熟后(8周),与野生型小鼠进行交配,获得F1代小鼠。
3. 对交配获得的F1代小鼠进行基因型鉴定,理论上,F1代小鼠中有50%为转基因杂合子小鼠,50%为野生型小鼠。
注意事项:
- 每只F0代基因型都不一样,不能进行F0之间的自交,只能先与野生型交配,筛选出基因型一致的F1。(假如F0代有多个位点的外源基因整合,F1还有可能有多种基因型)。
- 获得F1鼠后,可以进行蛋白表达鉴定,优先筛选出表达的鼠后再进行后续的传代和保种。
